Американський регулятор дав згоду на лікування пацієнтів із хворобою Альцгеймера новітнім препаратом Лекембі, про що FDA повідомляє на своєму сайті. Випробування показали, що він знижує кількість патологічного білка в мозку та злегка сповільнює когнітивне погіршення, однак низка вчених називають рішення ще однією помилкою FDA через занепокоєння щодо ефективності й безпечності засобу.
Що це за ліки?
Препарат з комерційною назвою Лекембі (Leqembi) від компаній Eisai та Biogen — це моноклональні антитіла леканемаб, які зв'язуються з патологічним білком-бета амілоїдом та допомагають позбутися його відкладень у мозку. Виробник встановив вартість терапії на рівні 26 500 доларів США на рік, називаючи її доступною для американців.
Лекембі — вже другий препарат цього класу, який отримав схвалення від Управління продовольства та медикаментів США (FDA). Першим були моноклональні антитіла до бета-амілоїду Адугельм від Biogen, що їх дозволили призначати пацієнтам у США 2021 року, спричинивши цим шквал незадоволення серед науковців і лікарів. Оскільки поява бета-амілоїдних бляшок є однією з характерних рис хвороби Альцгеймера, то за однією з гіпотез вона є причиною когнітивного порушення. У такому разі націлення на ці білки може відвернути або принаймні сповільнити деменцію.
Щодо Лекембі, випробування на 856 учасниках з хворобою Альцгеймера показало, що півтора року лікування призводить до статистично значущого зменшення кількості бета-амілоїдних бляшок, тоді як у групі плацебо подібного зменшення узагалі не відбувається. Засіб також сповільнює на 27 відсотків прогресування деменції.
Чому у препараті сумніваються?
Лекембі має незначний ефект на когнітивні здібності. Лікарі не впевнені, чи самі пацієнти та їхні опікуни зможуть помітити те сповільнення прогресування деменції. Це одна з причин, чому 12 науковців написали спільне повідомлення із закликом не схвалювати передчасно леканемаб (інші вчені, частина з яких мають конфлікт інтересів, у відповідь написали лист із 230 підписами «за» лікарський засіб).
Однак препарат все ж отримав схвалення, тому що показав здатність знижувати кількість амілоїдних бляшок. Показник обрали попередньою сурогатною кінцевою точкою випробування, щоб прискорити реєстрацію потенційно ефективного препарату. На вивчення здатності препарату власне покращувати розумові здібності пішло б багато часу, тож в FDA, схоже, вирішили, що краще вже зараз мати хоч якість препарати проти важкої недуги, які мають ефект на патологію, хай навіть і не дуже дієві, ніж не мати вибору. Але скандал виник не лише через ефективність, а й занепокоєння щодо безпечності.
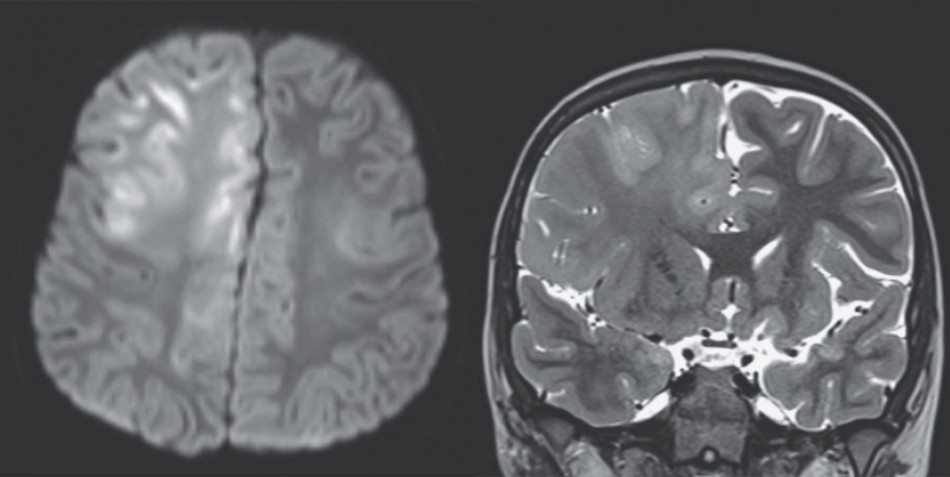
Як і з іншими моноклональними антитілами до бета-амілоїду, у частини пацієнтів Лекембі спричинив набряк та крововиливи у мозку. Це ускладнення, яке виробники рекомендують лікарям відстежувати регулярними МРТ-обстеженнями пацієнтів: щонайменше чотири в перші пів року, що суттєво здорожчує лікування. А незалежні розслідування пов'язують приймання Лекембі зі щонайменше двома смертями пацієнтів через ці побічні ефекти. Зважаючи на відсутність явного покращення стану пацієнтів, використання препарату може принести більше шкоди, ніж користі, вважають критики, які також наголосили в повідомленні на низці упереджень у результатах клінічного випробування.
Занепокоєння щодо схвалення подібних препаратів справедливе з огляду на те, що все ще невідомо, яку роль бета-амілоїдні бляшки відіграють у розвитку деменції. А дослідження, яке призвело до гіпотези, що накопичення бета-амілоїду призводить до погіршення когнітивних здібностей, нещодавно й узагалі назвали сфабрикованим, про що можна почитати у статті «Шукаючи правду про хворобу Альцгеймера».