Команда вчених використала нанокластери золота проти штамів бактерій, які виявляють множинну стійкість до лікарських препаратів. Ядро з 25 атомів золота було функціоналізоване двома лігандами: піридинієм — катіоном, що забезпечує бактерицидну дію, і цвітерріоном, який відповідає за стабільність і біосумісність з клітинами макроорганізму. Такі наночастинки золота ефективно знищували стійкі до антибіотиків грампозитивні бактерії, а їхнє використання спільно з антибіотиками підвищило антибактеріальну активність препаратів проти мультирезистентних бактерій як в культурах клітин, так і в дослідах на тваринах. Крім того, нанокластери золота добре виводились нирками та не пошкодили тканини макроорганізму, що було опубліковано у журналі Chemical Science.
Для чого змінювати уже наявні антибіотики?
Інфекції, викликані мультирезистентними бактеріями (стійкими до багатьох антибіотиків), стають все більшою проблемою глобальної охорони здоров’я: за останні роки резистентність патогенних мікроорганізмів до препаратів суттєво збільшилась. Стрімке поширення у лікарнях метицилін-резистентного епідермального стафілокока (МРСЕ) Staphylococcus epidermidis лише погіршує ситуацію через часті випадки горизонтального перенесення генів стійкості між мікробами. Тому постає нагальна потреба підібрати нові стратегії лікування резистентних штамів мікроорганізмів і пошуку методик вдосконалення уже наявних антибіотиків, у тому числі — матеріалів та елементів, якими можна додатково “навантажити” антибіотики.
Нанокластери золота як потенційно ефективні антибактеріальні засоби почали досліджувати не так давно. Вони можуть виявляти кілька антибактеріальних дій, які призводять до загибелі клітин: руйнувати оболонку клітини мікроорганізму і доставляти антибіотики всередину, спричиняти утворення активних форм кисню, забезпечувати фототермічне опромінення. Нанокластери золота розміром менш як 2 нм мають явну перевагу у швидкому нирковому кліренсі (швидкість очищення організму від ліків), що знижує потенційну довгострокову токсичність металу в організмі людини. Серед усіх нанокластерів золота найбільш вивченими є такі, що складаються з 25 атомів і поєднані з одним лігандом. Ці наночастинки є стабільними, мають низьку токсичність, зручні в обробітку. Крім того, можна досліджувати їхнє переміщення в живому об'єкті завдяки стабільній флуоресценції у ближньому інфрачервоному діапазоні. Однак відкритим залишалося питання створення “упаковки” для наночастинок золота, яка забезпечить доставку антибіотиків безпосередньо в клітину бактерій і буде безпечною для організму людини. Такими дослідженнями зайнялася команда науковців з Південного університету науки та технологій і Університету Удану в Китаї із британськими вченими з Університету Лідса.
Куди і як транспортували наночастинки золота?
З метою посилити антибактеріальний ефект і водночас забезпечити відсутність пошкоджень макроорганізму науковці оптимізували склад наночастинок з 25 атомів золота двома лігандами й визначали антимікробну дію цієї сполуки.
Перший ліганд — піридиній — катіон, позитивний заряд якого притягується до негативного заряду бактерій. Піридинієвий ліганд (P₁₂) отримали з цетилпіридинію хлориду — комерційної асептичної добавки для слизової оболонки ротової порожнини. Другий ліганд — цвіттеріон (C₅) — електронейтральна молекула, яка має і позитивно, і негативно заряджені групи; ці молекули містяться і в мембранах клітин ссавців, тому такі сполуки не реагують з клітинами макроорганізму і виводяться з сечею. Цвіттеріонний ліганд був введений через його біосумісність, біологічну безпеку та низьку схильність до біологічного обростання.
Антимікробну активність нанокластерів золота оцінювали, використовуючи кілька поширених грампозитивних (Staphylococcus aureus і його резистентна форма) і грамнегативних (Escherichia coli, Klebsiella pneumonia, Pseudomonas aeruginosa) бактерій. Препарати золота використовували самостійно або у поєднанні зі звичайними антибіотиками на клітинному рівні та на мишах зі шкірною інфекцією. Для безпосереднього моніторингу біорозподілу нанокластерів золота в організмі та можливих проявів цитотоксичності використали стабільну флуоресценцію у ближньому інфрачервоному діапазоні.
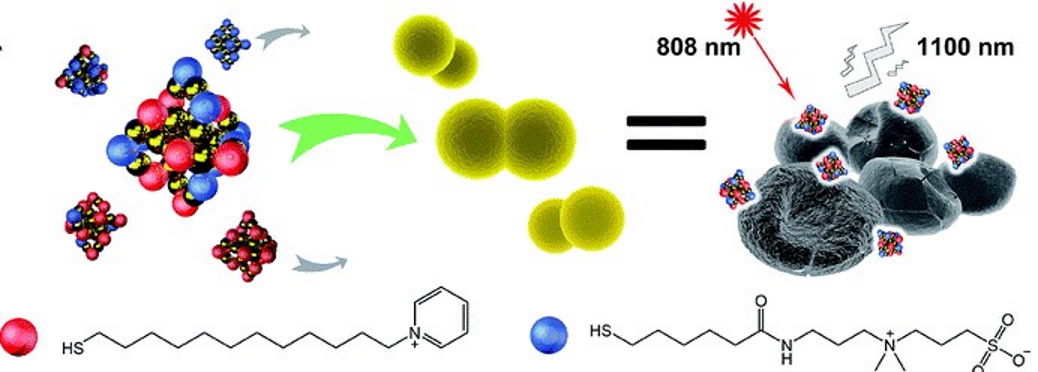
Схема дослідження. Нанокластери золота з лігандами у співвідношенні P₁₂/C₅ склеюють планктонні бактерії, взаємодіють з клітинною стінкою бактеріальної клітини, підтримуючи при цьому біосумісність. Локальні взаємодії нанокластерів золота з бактеріями зумовлюють витік цитоплазми клітини та її структурну деформацію, що спричиняє загибель клітини. Розподіл нанокластерів визначають за допомогою флуоресценції у ближньому інфрачервоному діапазоні при збудженні лазером за довжини хвилі 808 нм. Золоті сфери вказують на атоми золота, червоні – ліганди P₁₂ (піридиній), сині – ліганди C₅ (цвіттеріон). Zeyang Pang et al. / Chemical Science, 2021
Що вдалося досягти, вводячи золоті наночастинки?
З'ясувалося, що нанокластери мають більший вплив на грампозитивні мікроорганізми, оскільки поверхні їхніх клітин негативно заряджені, отже, мають сильні електростатичні взаємодії з катіонами. Тому подальші дослідження проводили лише на грампозитивних штамах — Staphylococcus epidermidis, Staphylococcus haemolyticus, Enterococcus faecium і їхніх мультирезистентних формах (МРСЕ, мультирезистентний S. haemolyticus і ванкоміцин-резистентний Enterococcus), використовуючи різний вміст піридинію (45, 50 і 100 відсотків).
Вчені встановили оптимальне співвідношення вмісту лігандів. Виявилось, що нанокластери золота Au₂₅(P₁₂)₈(C₅)₁₀), у яких з двох лігандів 45 відсотків припадає на піридиній (P₁₂), демонструють високу антибактеріальну активність, низьку цитотоксичність і хорошу стабільність.
Поєднання оптимізованих наночастинок золота зі звичайними антибіотиками підвищило антибактеріальну активність проти мультирезистентних бактерій як in vitro, так і на тваринах. Дослідження на мишах проводили за використання поширеного в лікарнях штаму — S. epidermidis (МРСЕ), у якого встановили найсильніше інгібування нанокластерами золота. Вчені обробили бактерії трьома антибіотиками різних класів (іміпенем, оксацилін і еритроміцин), як з нанокластерами золота, так і без них. За використання наночастинок золота для лікування інфекції було достатньо застосувати у 128 разів меншу кількість оксациліну, ніж у контролі (коли був застосований лише антибіотик без частинок металу).
При дослідженні швидкості загоєння ран встановили, що використання нанокластерів золота разом із антибіотиком іміпенемом дало найкращі результати — на дев'яту добу шкіра була повністю відновлена, а на дванадцяту добу чисельність мікроорганізмів була у 10 разів нижчою, ніж за використання лише наночастинок, і на два порядки нижчою від чисельності контролю.
Стабільність нанокластерів золота in vitro підтвердили в змодельованих біологічних рідинах, встановивши сталу флуоресценцію, яка була незмінною впродовж 15 діб. Сильну флуоресценцію наночастинок in vivo після внутрішньовенної ін’єкції нанокластерів золота з антибіотиком іміпенемом у мишей спостерігали переважно в печінці, нижчу – селезінці та нирках. Проте визначення вмісту золота в критичних органах показало, що через 96 годин понад 80 відсотків золота виводилося. Вчені підтвердили хороший нирковий кліренс та біосумісність — наночастинки металу добре фільтрувались нирками та не пошкоджували тканини макроорганізму.
Отже, вченим вдалося синтезувати й оптимізувати склад нанокластерів золота, до яких, окрім 25 атомів золота, увійшли ще два ліганди — піридинієвий і цвіттеріонний. Отримані наноматеріали демонстрували як хорошу антибактеріальну здатність проти мультирезистентних грампозитивних бактерій, так і високу стабільність в макроорганізмі. За антибактеріальний вплив нанокластерів золота на клітини бактерій відповідальними визначили такі ефекти: руйнування цілісності бактеріальної мембрани і зміну її потенціалу; склеювання клітин мікроорганізмів; утворення активних форм кисню, які окиснюють клітинні структури. Тобто, дія наночастинок була спрямована на сприяння проникненню антибіотиків всередину бактерій через їхню пошкоджену мембрану, а також на значне пригнічення життєздатності бактеріальних клітин та створення стресових умов, за яких ті поступово гинули. Використання таких оптимізованих біосумісних нанокластерів золота значно зменшило дозу антибіотиків, необхідну для лікування мультирезистентних бактеріальних інфекцій. Перелічені переваги роблять такі наночастинки потужним інструментом для біовізуалізації, доставки ліків та терапії. Крім того, використання таких технологій допоможе “виграти час” для модифікації уже існуючих антибіотиків.
Проте, допомоги у подоланні патогенних мікроорганізмів можна шукати й без використання антибіотиків. Нещодавно стало відомо, що пептиди тіла людини проявляють антибактеріальну дію.