Нанофібрили із речовинами, що сприяють відновленню та виживанню клітин спинного мозку після його травмування, мають кращу ефективність, якщо зробити їхні молекули рухливішими. Це показало дослідження американських вчених, під час якого миші із травмою спинного мозку краще відновлювалися та повертали собі рухову функцію, якщо отримали ін'єкцію нанофібрил із посиленою рухливістю їхніх молекул. Результати опубліковані в журналі Science.
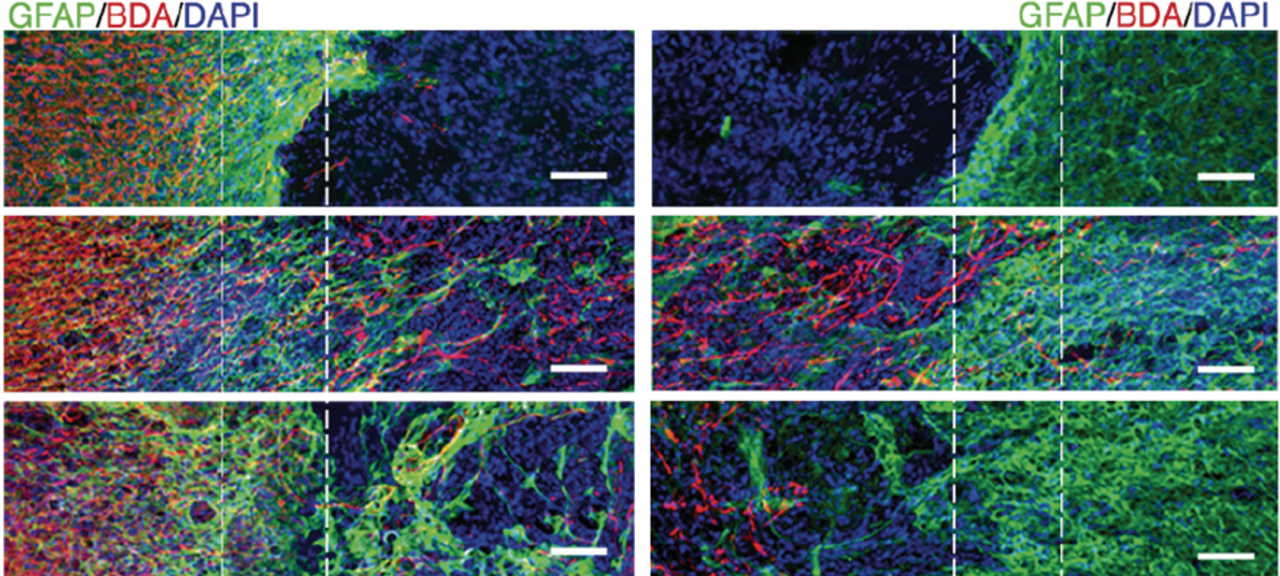
Зображення місця пошкодження спинного мозку мишей. Верхній ряд — нелікованих, середній і нижній — лікованих різними комбінаціями пептидів. Зеленим позначено астроцити, червоним — аксони, синім — ядра клітин. Zaida Álvarez et al. / Science, 2021
Який спосіб лікування травми спинного мозку привернув увагу вчених?
Травмування спинного мозку може призводити до важких порушень рухливості, наприклад, до паралічу кількох чи всіх кінцівок. Часто ці наслідки є невідворотними через низьку здатність нервової системи до регенерації та утворення рубцевої тканини, яка ще більше ускладнює загоєння. Поки що немає такого лікування, яке з високою ефективністю може відновити рухову функцію. Утім, дослідження показують, що окремі хімічні речовини здатні допомогти. Наприклад, хондроітиназа АВС розчиняє гліальний рубець, що перешкоджає відновленню нервів. Інші вчені вбачають рішення у сполуках, що з'єднуючись із відповідними рецепторами клітин активують процеси регенерації. Природно такими сполуками є білки, але їхнє фармакологічне використання обмежене коротким періодом дієздатності в людському організмі після їх введення, а також високою вартістю виготовлення.
Потенційно допомогти можуть штучні матеріали із властивостями позаклітинного матриксу, які містять більш малі молекули пептиди, що імітують дію конкретних білків і, так само, зв'язуючись із рецепторами клітин, можуть активувати процеси загоєння. При з'єднанні їх у великі щільні полімери, вони можуть «жити» та діяти в організмі набагато довше за білки. Вивчаючи такий підхід до лікування травм спинного мозку, науковцям із Північно-Західного університету та Дослідницької лабораторії ВПС США вдалося добитися значних успіхів у дослідах на тваринах.
Яким чином регенерації спинного мозку досягли разу?
Науковці створили супрамолекулярну структуру із полімерів, що завдяки нанорозмірним фібрилам вдало імітує середовище позаклітинного матриксу. Його терапевтична дія зумовлена наявністю двох типів пептидів у складі фібрил. Перший, IKVAV, відомий сприянням перетворенню нейрональних стовбурових клітин у нейрони та подовженню аксонів — довгих відростків нейронів, які, серед іншого, проводять сигнали до м'язових волокон. Інший пептид має назву YRSRKYSSWYVALKR, і він сприяє розростанню клітин та їхньому виживанню.
Але щоб ці речовини подіяли та запустили бажані клітинні процеси, вони мусять зв'язатися із відповідними рецепторами на поверхні клітин. Це не так вже й просто, зважаючи на те, що рецептори та інші структури мембрани клітин перебувають у русі та постійно змінюють своє розташування. Щоб посприяти взаємодії пептидів із рецепторами, науковці модифікували не біоактивні ділянки фібрил таким чином, щоб зробити їх більш рухливими. Завдяки цьому молекули, як і рецептори, постійно перебувають у русі, іноді навіть від'єднуються від супрамолекулярних структур, що збільшує ймовірність їхнього контакту.
Препарат зручно застосовувати у вигляді ін'єкції. При введенні він рідкий, але після потрапляння в місце ураження швидко утворює гелеву структуру із нанофібрилами. У такому вигляді він може протягом тижнів перебувати й діяти в організмі, а приблизно за 12 тижнів самостійно та безпечно деградує. Випробування засобу провели на мишах через 24 години після важкого пошкодження спинного мозку, яке проявилося паралічем нижньої частини тіла, зокрема кінцівок, тварин. Ефективність препарату порівнювали з дією ін'єкції звичайного сольового розчину.
Як подіяв препарат на мишей?
За 12 тижнів спостереження у мишей, що їм ввели сольовий розчин, майже не виявили відновлення аксонів. Натомість у групі лікування комбінованим препаратом відновлення аксонів було у 50 разів більшим, а крім цього спостерігалося посилене покриття аксонів мієліном — ізолювальним білком, який забезпечує швидке та коректне передавання електричних сигналів. Терапія також проявилася суттєво меншою щільністю гліального рубця в місці пошкодження, у порівнянні з нелікованими мишами. У мишей після ін'єкції препарату за три місяці на місці пошкодження утворилася нова мережа кровоносних судин, у порівнянні з мишами після уколу сольового розчину. Біля цих судин спостерігалася більша кількість нейронів, зокрема мотонейронів; картина була подібною до такої в здорових тварин із непошкодженим спинним мозком. Це вказує на те, що лікування справді допомогло підвищити виживаність нейронів. Зміни від лікування були помітні й у поведінці тварин. Уже за три тижні після враження у групі препарату тварини продемонстрували найкращі показники, частково відновивши рухову функцію, зокрема змогу ходити.
Відтак вчені провели досліди в пробірках із людськими клітинами судин та клітинами-попередниками нейронів. Досліди знову показали, що пептиди в складі фібрил здатні запустити необхідні для загоєння спинного мозку клітинні процеси.
Що цікаво, найбільша терапевтична ефективність (відновлення аксонів та кровоносних судин, функціональне покращення) спостерігалося при застосуванні фібрил із найбільш рухомими молекулами. Вчені вважають це доводом на користь того, що постійна зміна форми фібрил внаслідок їхніх сильно рухомих молекул сприяє кращій взаємодії з рецепторами. Але не виключено, що динамічна мережа фібрил впливає на клітини опосередковано, краще взаємодіючи із білками позаклітинного матриксу. Вчені сподіваються, що їхнє відкриття про посилену біоактивність супрамолекулярних фібрил з підвищеною мобільністю може посприяти лікуванню й інших захворювань.
Науковцям не вперше вдається повернути можливість ходити мишам із травмою спинного мозку. На початку року вийшло дослідження, де подібних успіхів вдалося досягти завдяки інструментам генної терапії.
NorthwesternU / Youtube