Сінгапурські вчені створили стійкі до шлункового соку пробіотики за комбінованою методикою інкапсуляції в альгінаті — природному полісахариді з водоростей. У дослідах лактобактерії вкрили полімером на основі альгінату та сахарози, зшитого іонами кальцію, з подальшим їх висушуванням розпиленням, що посприяло виживанню бактерій у шлунковому соку. Про свою розробку автори повідомили у журналі Carbohydrate Polymers.
Як і для чого інкапсулюють пробіотики?
Інкапсуляція передбачає покриття бактерій полімерним шаром, який буде ізолювати їх від зовнішнього середовища. Зменшивши взаємодію з оточенням, можна подовжити термін придатності, стійкість бактерій до різних середовищ, в тому числі до кислого шлункового соку. Популярною є технологія висушування розпиленням, яка полягає у швидкому висушуванні рідини або емульсії струменем нагрітого інертного газу або повітря, у результаті чого утворюється дрібнодисперсний порошок. За цією технологією частинки інкапсульованих пробіотиків генеруються усього за одну стадію, що робить процес ефективним та економним.
Хоч така технологія і набула широкого використання, вона має недолік: через високу температуру та низьку вологість зменшується кількість живих бактерій. А полімеризація альгінату — найбільш поширеного полімеру для інкапсуляції — вимагає водного середовища, що погано суміщається з висушуванням. Вчені Наньянського технологічного університету вирішили використати нещодавно розроблену модифікацію цієї технології для вкриття лактобактерій полімером на основі альгінату.
Чому саме альгінат?
Альгінат давно зарекомендував себе як біосумісний та загалом безпечний компонент, але насправді суміш для вкриття лактобактерій містила окрім альгінату ще сахарозу та кальцій. При полімеризації молекули альгінату зв’язуються у довгий ланцюг, а для створення більш міцної матриці додають катіони кальцію, за допомогою яких виникає ще й перехресне зшивання молекул. Відомо, що кальцій-альгінатні полімери забезпечують ефективний захист мікроорганізмів від шлункового соку, а також сприяють кращому вивільненню у кишківнику. А сахарозу використали в якості компоненту, що сприяє виживанню більшої кількості бактерій після висушування високими температурами.
Як отримували інкапсульовані пробіотики?
Головна ідея модифікованої методики — у створенні двох коаксіальних потоків рідин, які виходять із нагрітого сопла одночасно. При зіткненнях молекули взаємодіють і утворюють полімерну матрицю. Далі під дією стиснутого повітря частинки розпилюються, після чого висушуються нагрітим повітрям, а готовий порошок осідає на стінках колектора.
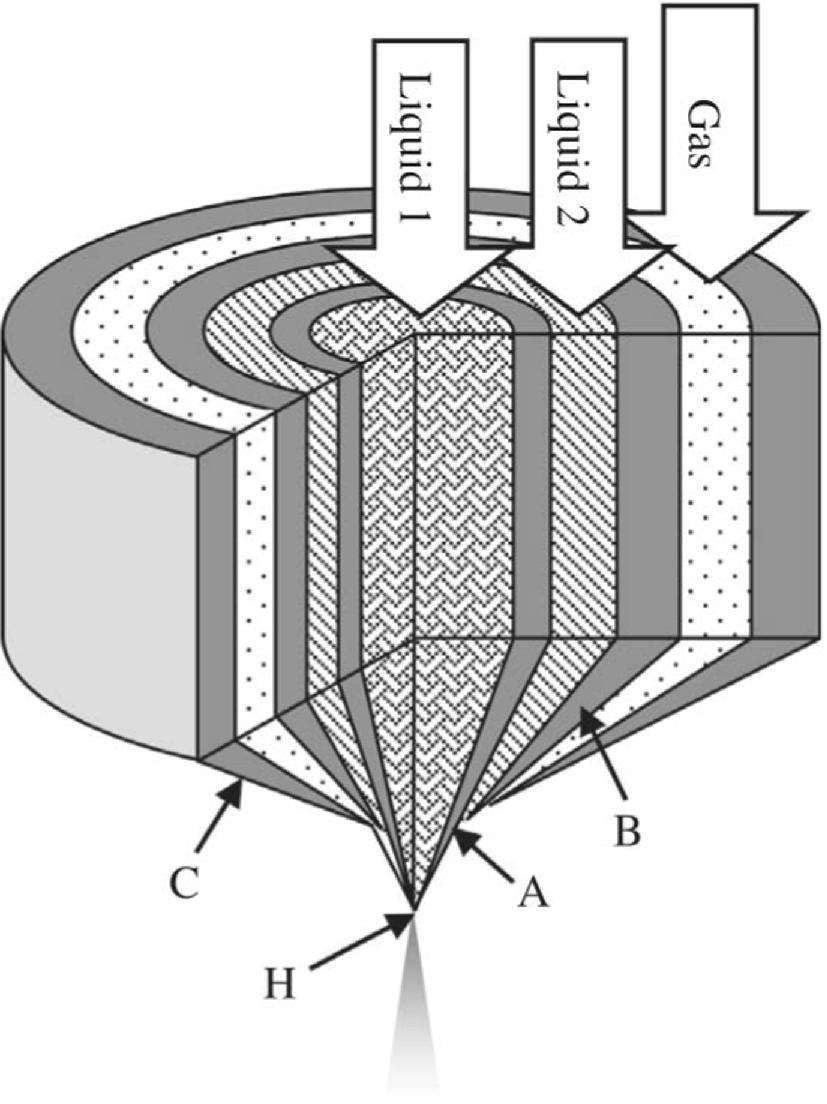
Схема сопла: А - внутрішній канал, В - зовнішній канал, С - канал для стиснутого повітря, Н - вихід із сопла, де об’єднуються усі три потоки. Sharad Kharel et al. / Journal of Functional Foods, 2021
Суміш лактобактерій (Lacticaseibacillus rhamnosus GG), альгінату, сахарози та кальцію подавали у сопло за двома різними схемами, назвемо їх прямою та оберненою. У прямій схемі на внутрішній канал сопла подавали емульсію пробіотиків з альгінатом та сахарозою, а у зовнішній — іони кальцію. В оберненій, відповідно, кальцій подавали через внутрішній канал, а все інше — через зовнішній. В результаті отримували дрібнодисперсний порошок, розмір частинок якого становив від 2 до 34 мікрометрів.

Зображення отриманих порошків зі сканувального електронного мікроскопа: e) пряма схема, f) обернена схема. Li Ling Tan / Carbohydrate Polymers, 2022
Чи вдалося покращити властивості пробіотиків?
Перш за все, перевірили, яка кількість клітин перенесла нагрівання у процесі розпилення. Виявилося, що кількість живих бактерій в обох порошках майже не змінилася у порівнянні з початковою кількістю та містила більше мільярда колонієутворюючих одиниць (КУО) в одному грамі інкапсульованого пробіотика.
Для вивчення стійкості до агресивного середовища шлунку порошки піддавали дії штучного шлункового соку впродовж однієї години. Після цього кількість КУО в одному грамі порошку, отриманого за оберненою схемою, знизилася на три порядки, а от для прямої схеми — майже не змінилася. Автори припускають, що така чутливість полімерної матриці до кислого середовища викликана тим, що катіони кальцію подавалися через внутрішній канал і, відповідно, зшивки розміщувалися в ядрі частинок, а зовні були вразливі до кислоти молекули альгінату.
Також дослідили строк придатності пробіотиків отриманих за прямою схемою. За чотирьох градусів Цельсія вони зберігалися впродовж 8 тижнів, майже не змінюючи своєї стійкості до кислого середовища. А от за кімнатної температури інкапсульовані таким чином пробіотики за той же час втратили значну кількість живих бактерій.
Використана технологія інкапсуляції придатна і для інших видів лактобактерій. Це вчені продемонстрували на двох видах — L. plantarum та L. paracasei. Обидва види інкапсульованих пробіотиків виявилися стійкими до дії шлункової кислоти.
Нова технологія інкапсуляції пробіотиків дійсно працює для лактобактерій та може скласти конкуренцію сучасним процесам виготовлення пробіотиків. Завдяки одностадійності процесу зменшується ризик забруднення продукту та витрати матеріалу. На думку авторів, ця технологія може бути застосована і до інших видів бактерій за умови налаштування параметрів виробництва.