Американські вчені створили біосумісний гідрогель на основі альгінату, який поступово вивільняє ліки та антитіла в місці хірургічного видалення пухлини задля запобігання її рецидиву або поширення на інші частини тіла. Гель посилює імунну відповідь у місці його введення, чим допомагає стримувати зростання пухлин. Ефективність гелю випробували на мишах із різними видами раку, про що йдеться в журналі Nature Communications.
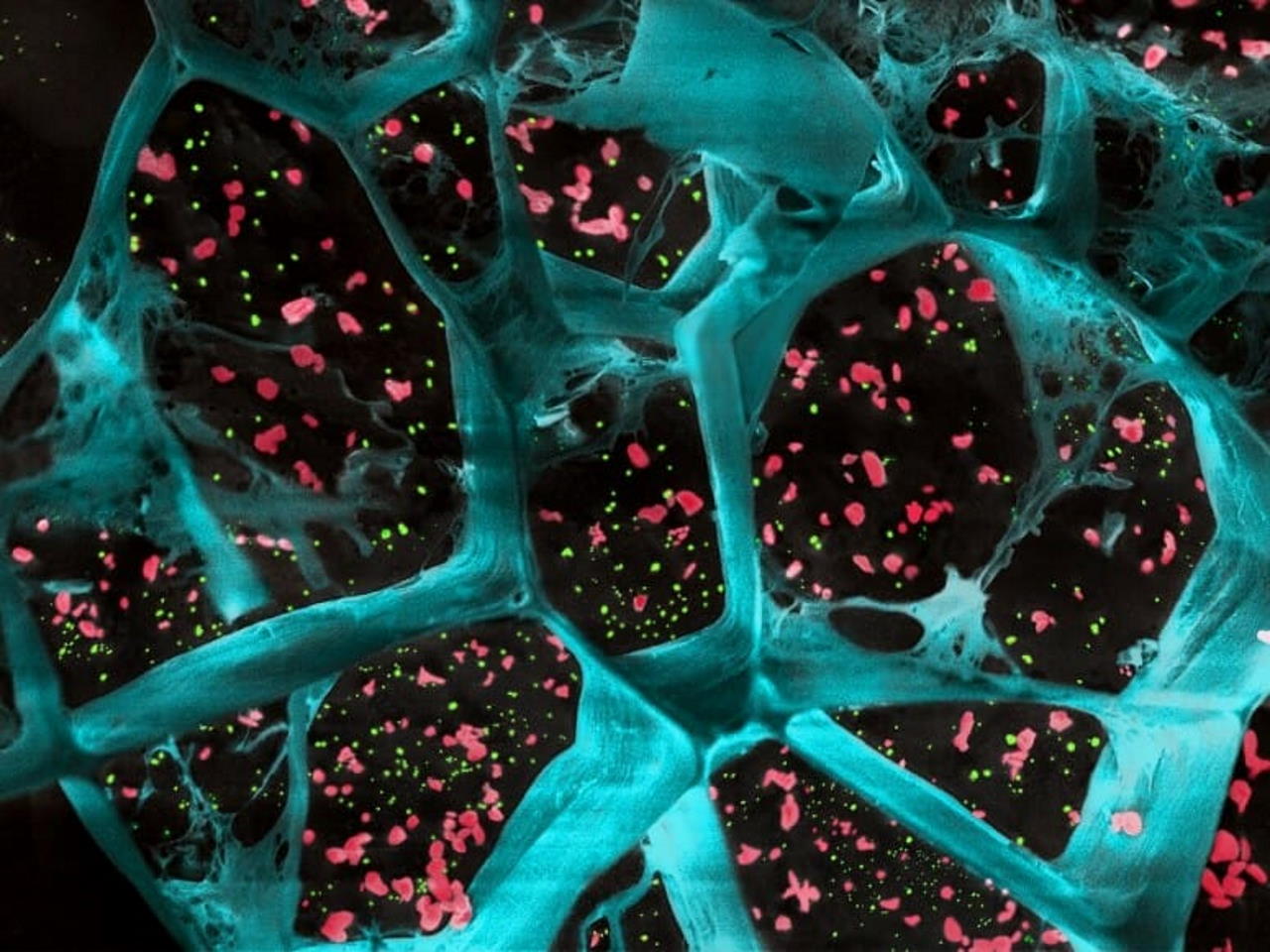
Гідрогель у великому збільшенні (синій колір) із інкапсульованими тромбоцитами, що активують Т-клітини, та наночастинками з препаратом для пригнічення ракових клітин (зелений колір). University of Wisconsin-Madison
Чому може виникнути рецидив пухлини?
Основним варіантом лікування пацієнтів із твердими пухлинами залишається хірургічне втручання. Але після операції може залишатися невелика кількість ракових клітин, які можуть дозволити відрости пухлинам знову. Тоді виникає рецидив пухлини або ж її метастазування, через що скорочується тривалість життя пацієнтів. Імунотерапія раку, тобто штучна стимуляція імунної системи для лікування раку, особливо блокада імунних контрольних точок, показала свою ефективність проти рецидивів раку у вигляді монотерапії або в комбінації з іншими методами лікування. Однак фізіологічні зміни після операції, особливо запальний стан, викликаний загоєнням ран, та імуносупресія, що реагує на запалення, можуть знизити ефективність імунотерапії раку.
У процесі загоєння хірургічної рани та відновлення тканин бере участь значна кількість запальних клітин, представлених макрофагами. Але асоційовані з пухлиною макрофаги (TAM) виділяють велику кількість протизапальних факторів, таких як інтерлейкін 10 (IL-10), для формування імуносупресивного мікросередовища, через що клітини пухлин можуть уникнути імунного нагляду та призвести до рецидиву й метастазування. Зв'язок між макрофагами, асоційованими з пухлиною (TAM), і рецидивом раку після операції встановлений як у доклінічних дослідженнях, так і в клінічних умовах. Було продемонстровано, що хірургічне втручання може посилити розростання пухлинних клітин локально та у віддалених метастазах, що корелює зі збільшенням щільності макрофагів у тканинах пухлини після операції. Тоді як виснаження асоційованих з пухлиною макрофагів призводить до гальмування росту пухлини після операції. Крім того, у клінічних умовах показник TAM часто застосовується як прогностичний маркер рецидивів деяких видів раку після операції.
У сукупності всі ці доклінічні та клінічні дослідження підтверджують, що існує сильна кореляція між збільшенням кількості TAM і рецидивом пухлини після операції, тоді як зменшення кількості TAM може мати позитивний вплив на запобігання рецидиву пухлини після операції. Тому вчені з Університету Вісконсін-Медісон створили біосумісний гідрогель на основі альгінату, який поступово вивільняє лікувальні препарати у хірургічну рану та пригнічує діяльність асоційованих з пухлиною макрофагів.
Як працює створений дослідниками гідрогель?
Альгінатний гель містить лише дві активні складові. Першою є направлений на уповільнення росту ракових пухлин препарат пексидартиніб (PLX). Його дозволено використовувати для пригнічення функції TAM, що, як відомо, сприяють розростанню ракових клітин. Інший компонент складається з антитіл PD-1, зв'язаних з тромбоцитами для стабільності. Ці антитіла допомагають імунним Т-клітинам розпізнавати та атакувати ракові клітини. Такою комбінацією дослідники сподівалися досягти локального та тривалого вивільнення пексидартинібу та антитіл PD-1 для виснаження TAM та реактивації Т-клітин відповідно. Крім того, це мало б мінімізувати побічні ефекти, які виникають, коли ці препарати вводяться внутрішньовенно та циркулюють в усьому організмі.
Як випробували дієвість гідрогелю?
Створений гель протестували на мишах із рецидивами різних видів раку: меланоми, раку товстої кишки та агресивної форми раку молочної залози й саркомі. Рецидив меланоми відтворили за допомогою хірургічного втручання, коли розмір пухлини досяг приблизно 150 кубічних міліметрів. Під час операції під мікроскопом максимально ретельно видаляли пухлинну масу. Після цього мишей обробляли фізіологічним розчином або гідрогелем з різним навантаженням препаратів у різних дозах.
Для подальшого визначення імунотерапевтичної ефективності гідрогелю створили мишача модель рецидиву раку товстої кишки. Повторюваний ріст пухлини відстежували шляхом вимірювання сигналів біолюмінесценції від цих клітин. Післяопераційним мишам знову застосовували різні види лікування, включаючи фізіологічний розчин і гідрогель на основі альгінату з пексидартинібом та антитілами PD-1. Вбудовані в гідрогель ліки імплантували в порожнину пухлини після операції. Сигнали біолюмінесценції пухлин використовувалися для моніторингу росту пухлини протягом тривалого курсу лікування.
Потрійно-негативний рак молочної залози є дуже агресивним і метастазуючим, та зазвичай погано реагує на терапію блокадою імунних контрольних точок. Тому дослідники вирішили протестувати гідрогель і на цьому виді раку подібним до вищеописаного способом. Додатково також встановили ефективність на пухлині саркоми, яка теж є агресивним видом раку та володіє обмеженою імунотерапевтичною відповіддю.
Як вплинув гідрогель на рак мишей?
У випадку з меланомою кількість макрофагів у тканинах пухлини, оброблених гідрогелями з пексидартинібом була знижена, у порівнянні з групами фізіологічного розчину. Однак миші, які отримували лікування гідрогелем з пексидартинібом та антитілами, показали найбільш помітний захист від рецидиву пухлини, що обґрунтовує перевагу цього гідрогелю як локального резервуара для тривалого вивільнення PLX та PD-1. Потужна протипухлинна активність такої комбінації була додатково продемонстрована вищою виживаністю мишей. Якщо в контрольній групі миші прожили менш як 30 днів, то ті, пухлини яких обробляли гідрогелем, прожили у середньому 70 днів.
Різні конфігурації гідрогелю проти пухлин у мишей в групі з раком товстої кишки показали помірні протипухлинні ефекти. У групі фізіологічного розчину всі миші загинули протягом 36 днів, натомість у групі гелю з пексидартинібом та антитілами понад 60 відсотків мишей були живими протягом 70 днів. На біосумісність гідрогелю без явної токсичності вказувала відсутність значної втрати ваги мишей протягом тривалого курсу лікування.
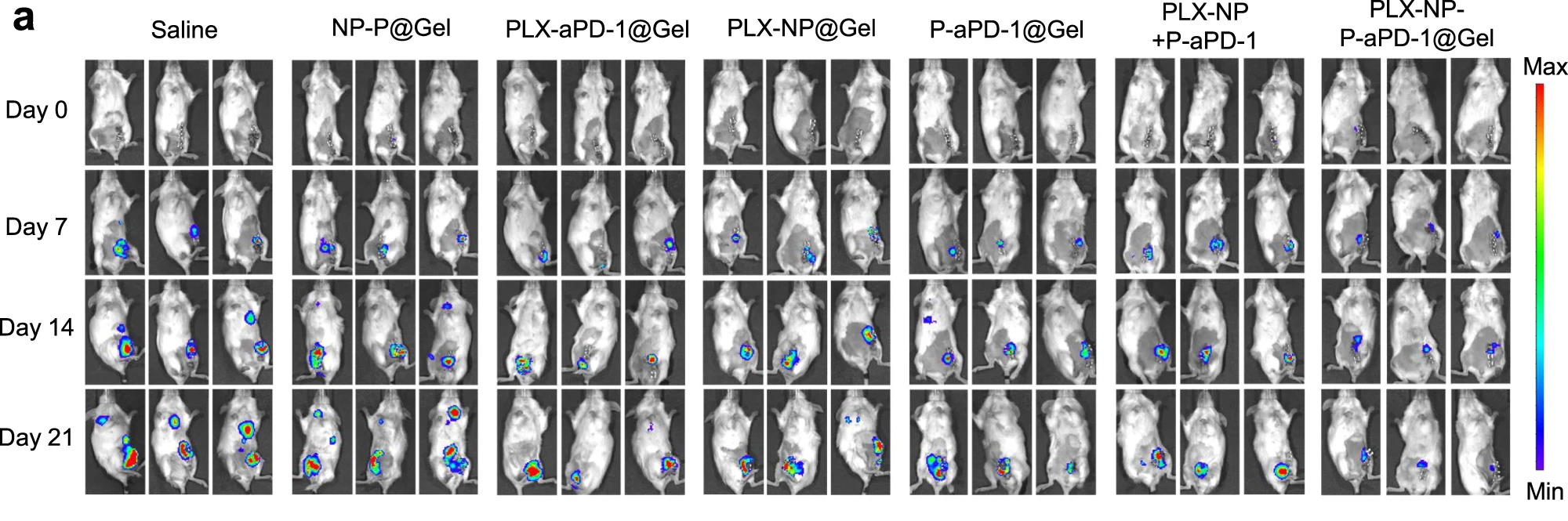
Репрезентативні біолюмінесцентні зображення мишей з пухлиною молочної залози після різних обробок на день 0, день 7, 14 та 21. Li, Z., Ding, Y., Liu, J. et al. Nature Communications, 2022
Результати тестування на моделях рецидиву пухлини молочної залози були схожі з іншими моделями. Всі миші в групі фізіологічного розчину загинули протягом 33 днів, тоді як після лікування сумішшю з PLX та PD-1 понад 66 відсотків мишей прожили більше ніж 60 днів, що перевершує ефективність інших стратегій лікування. Крім цього, вчені створили модель метастазування пухлини молочної залози в легені та випробували на ній експериментальне лікування. На 21 день легені мишей відбирали для аналізу. Зрештою, лікування гідрогелем з PLX та PD-1 і цього разу найсильніше зменшило кількість метастатичних вузлів на поверхні легень, у порівнянні з іншими групами лікування, тоді як у групі фізіологічного розчину в легенях спостерігали важкі метастази. Схожі обнадійливі результати ефективності гідрогелю показала і модель саркоми.
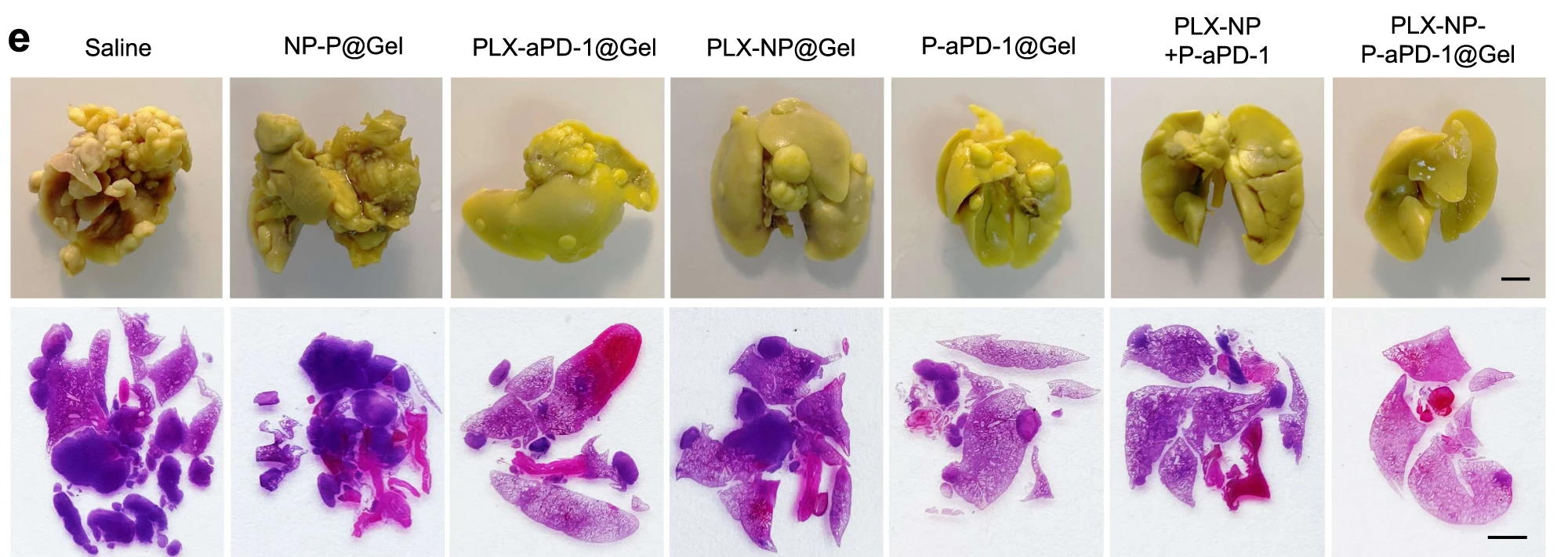
Зображення легенів після фіксації в розчині Буена та фарбування, на 21 день після різного лікування (де Saline – це фізіологічний розчин, а PLX-NP-P-aPD-1@Gel — обробка гідрогелем, з пексидартинібом та антитілами PD-1). Li, Z., Ding, Y., Liu, J. et al. Nature Communications, 2022
Отже, у кожному випадку гель суттєво сповільнював ріст ракових клітин без значних побічних ефектів і збільшував тривалість життя мишей. Результати показали, що гідрогель з пексидартинібом та антитілами PD-1може діяти як місцевий резервуар для забезпечення тривалого вивільнення ліків для підвищення ефективності імунотерапії пухлини шляхом виснаження макрофагів, асоційованих з пухлиною. Додаткові успішні досліди на моделях тварин в майбутньому можуть посприяти клінічним випробуванням гелю на людях.