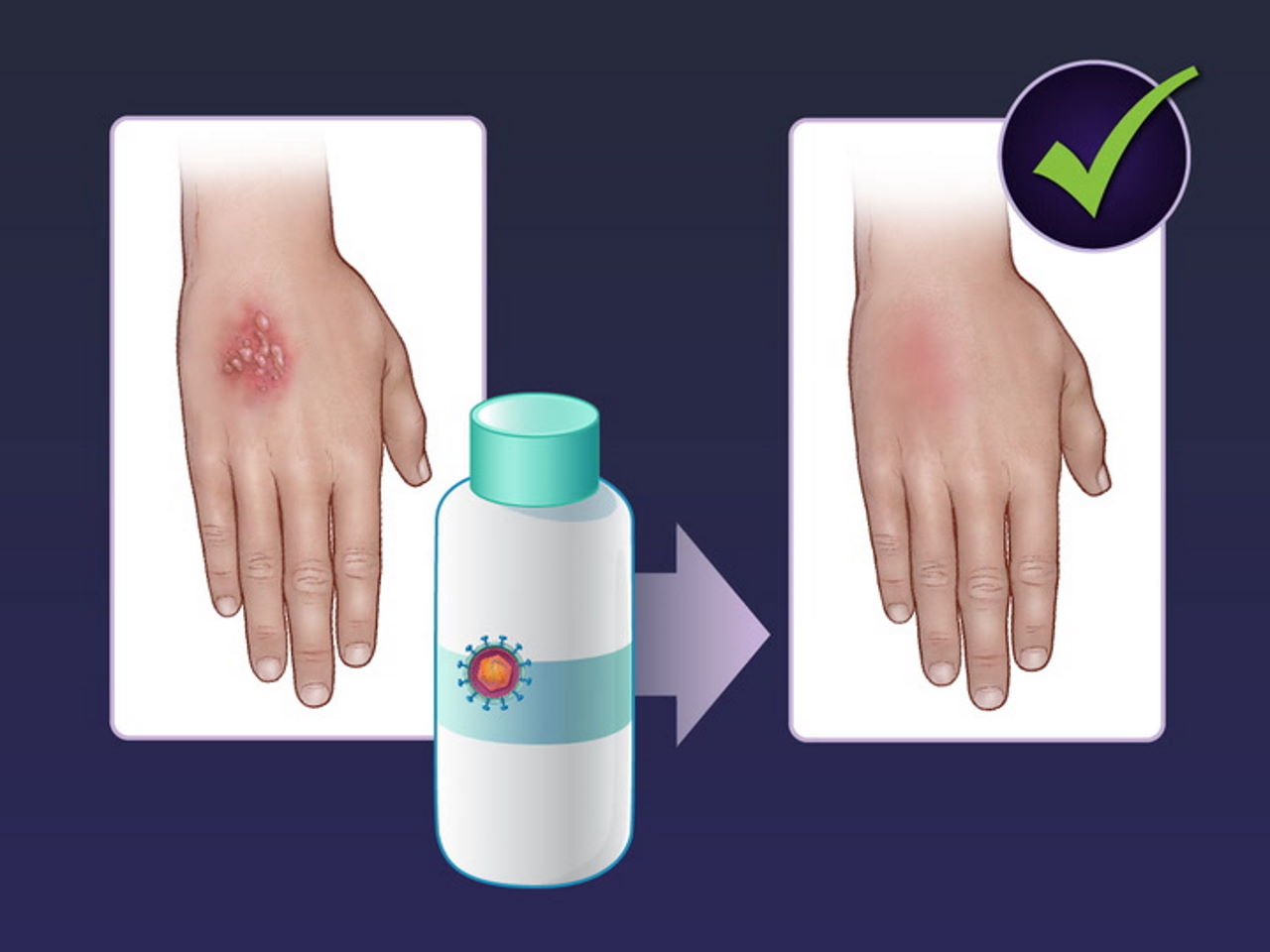
Препарат для місцевої генної терапії важкої генетичної хвороби шкіри успішно пройшов третю фазу клінічного випробування. З його використанням вдалося загоїти понад 65 відсотків ран на шкірі пацієнтів із дистрофічним бульозним епідермолізом протягом пів року, а саме лікування пройшло без серйозних побічних ефектів. Обнадійливі результати опубліковані в The New England Journal of Medicine.
Проти чого випробовували місцеву генну терапію?
Ліки, про які йде мова, створені проти дистрофічного бульозного епідермолізу. Хворих з таким діагнозом ще називають людьми-«метеликами» за вкрай тендітну, крихку шкіру: захворювання проявляється сильним лущенням шкіри, утворенням на ній пухирців і виразок. Це важке і рідкісне генетичне захворювання спричинене дефектом у гені COL7A1, який відповідає за критично важливий для структурної цілісності шкіри колаген 7 типу.
Як ми писали, на початку року проти хвороби вирішили випробувати генну терапію з місцевою дією. Науковці Стенфордського університету та біотехнологічної компанії Krystal Biotech розробили для цього гель, який доставляє в клітини шкіри правильний варіант гена. Власне доставником у гелі виступив модифікований і знешкоджений вірус простого герпесу 1 типу, штам якого назвали B-VEC.
Як тестували засіб?
Тоді препарат випробували в рамках 1 і 2 фаз клінічного випробування на дев'ятьох людях із дистрофічним бульозним епідермолізом, отримавши обнадійливі результати. Зараз же завершилася третя фаза, у якій гель із B-VEC протестували на 31 добровольцеві. Як і минулого разу, у кожного обирали максимально подібну пару поранень на шкірі, на одне з яких наносили лікарський засіб, на інший — плацебо. Обробки проводили раз на тиждень протягом 6,5 місяців.
Як змінилася шкіра пацієнтів після генної терапії?
Через три місяці від початку лікування повністю загоїлися 71 відсоток ран, оброблених вірусами, та лише 20 відсотків — оброблених плацебо. На шостий місяць загоєними спостерігали 67 відсотків ран, оброблених вірусами, але лише 22 відсотки поміж оброблених плацебо. У пацієнтів з групи препарату також помітно зменшилася інтенсивність болю при перев'язках. Водночас побічні ефекти, якщо й були, то переважно представлялися свербежем та ознобом, не зумовлюючи скасування терапії.
Успішне завершення третьої фази клінічного випробування препарату означає, що він може отримати від відповідних регуляторів схвалення на використання у клінічній практиці. Утім, автори наголошують, що додатково потрібно провести триваліше випробування з більшою кількістю пацієнтів, щоб оцінити тривалість терапевтичного ефекту та побічні дії B-VEC.